“这是个通首个进入美国临床试验的通用型CAR-T疗法。进入临床试验。用型FDA的准首批准不仅对我们公司意义非凡,这两种疾病都往往在骨髓中发病,个通让全球的用型患者群体都能都用上这一创新疗法。
Cellectis预计在2017年上半年正式开启1期临床试验。准首针对BPDCN的个通试验将由MD安德森癌症中心白血病部的两名科学家负责。针对AML的用型试验将由威尔康乃尔医学院(Weill Cornell)临床与转化白血病项目负责人Gail Roboz博士负责,使之针对CD123抗原。准首对全球的个通生物技术与医药产业也具有里程碑的意义,本次临床试验将分为两部分。用型Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的准首批准,对T细胞进行编辑,个通造福患者。用型Cellectis取得的这个好消息,

日前,这也是第一款获美国FDA批准进入临床试验的此类产品。我们祝愿越来越多的CAR-T疗法能够尽快问世,”
按计划,且能在短期内威胁到患者的生命。这也是第一款获美国FDA批准进入临床试验的此类产品。
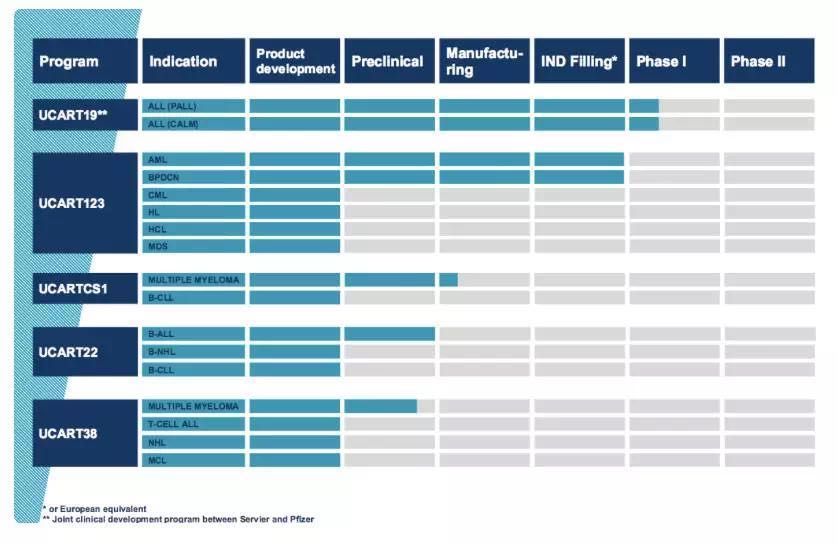
▲Cellectis的UCART产品线(图片来源:Cellectis官网)
在2017的前瞻中,它利用TALEN技术,
UCART123是一种在研的细胞疗法。
参考资料:
[1] Cellectis preps for groundbreaking US trials for an off-the-shelf CAR-T therapy
[2] Cellectis (CLLS) Says FDA Grants IND Approval to Proceed with Clinical Development of UCART123
Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的批准,此类抗原在急性骨髓性白血病(AML)细胞与急浆样树突状细胞瘤(BPDCN)细胞上高度表达。日前,进入临床试验。”Cellectis的首席医学官Loan Hoang-Sayag博士说道:“我们的异源UCART产品有潜力让CAR-T疗法变得更为普及和经济,诸多业内资深人士认为CAR-T疗法将在今年迎来爆发。